Белок А - Protein A
| Белок А | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| Идентификаторы | |||||||
| Символ | Спа | ||||||
| SCOP2 | 1DEE / Объем / СУПФАМ | ||||||
| |||||||
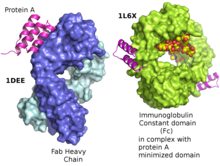
Белок А 42 кДа поверхность белок первоначально обнаружен в клеточной стенке бактерий Золотистый стафилококк. Он закодирован спа ген и его регуляция контролируется топологией ДНК, осмолярностью клетки и двухкомпонентная система называется ArlS-ArlR. Он нашел применение в биохимических исследованиях из-за его способности связывать иммуноглобулины. Он состоит из пяти гомологичных Ig-связывающих доменов, которые складываются в трехспиральный пучок. Каждый домен способен связывать белки многих видов млекопитающих, в первую очередь IgGs. Он связывает тяжелую цепь в Fc регион большинства иммуноглобулинов, а также в Fab регион в случае человеческого семейства VH3. Благодаря этим взаимодействиям в сыворотке, где молекулы IgG связаны в неправильной ориентации (относительно нормального антитело функция), бактерии нарушают опсонизация и фагоцитоз.[3]
История
В качестве побочного продукта своей работы над типоспецифичными антигенами стафилококка Вервей сообщил в 1940 году, что белковая фракция, полученная из экстрактов этих бактерий, неспецифически преципитировала кроличьи антисыворотки против различных типов стафилококков.[4] В 1958 году Дженсен подтвердил открытие Вервея и показал, что сыворотки до иммунизации кроликов, а также нормальные сыворотки человека связываются с активным компонентом экстракта стафилококка; он обозначил этот компонент как антиген А (потому что он был обнаружен во фракции А экстракта), но думал, что это полисахарид.[5] Ошибочная классификация белка была результатом ошибочных тестов. [6] но вскоре после этого (1962 г.) Лёфквист и Сьёквист исправили ошибку и подтвердили, что антиген A на самом деле является поверхностным белком на бактериальной стенке некоторых штаммов S. aureus.[7] Группа Бергена из Норвегии назвала белок «Протеин А» в честь фракции антигена, выделенной Йенсеном.[8]
Связывание с белком А антителом
С помощью кристаллографического уточнения было показано, что первичный сайт связывания протеина A находится в области Fc, между доменами CH2 и CH3.[9] Кроме того, было показано, что белок А связывает молекулы человеческого IgG, содержащие фрагменты IgG F (ab ') 2 из семейства генов VH3 человека.[10]
Белок A может связываться с сильным сродством с Fc-частью иммуноглобулина определенных видов, как показано в таблице ниже.[11]
| Разновидность | Подкласс | Привязка |
|---|---|---|
| Человек | IgA | Переменная |
| IgD | слабый или нет | |
| IgE | слабый или нет | |
| IgG1 | сильный | |
| IgG2 | сильный | |
| IgG3 | слабый или нет | |
| IgG4 | сильный | |
| IgM | Переменная | |
| Желток птичьего яйца | IgY | слабый или нет |
| Бычий | средний | |
| Собачий | средний | |
| Козел | слабый или нет | |
| морская свинка | IgG1 | сильный |
| Хомяк | слабый | |
| Лошадь | средний | |
| Коала | слабый или нет | |
| Лама | слабый или нет | |
| Обезьяна (резус) | сильный | |
| Мышиный | IgG1 | слабый |
| IgG2а | сильный | |
| IgG2 | от среднего до сильного | |
| IgG3 | средний | |
| IgM | Переменная | |
| Свинья | от среднего до сильного | |
| Кролик | сильный | |
| Крыса | IgG1 | слабый или нет |
| IgG2а | слабый или нет | |
| IgG2b | слабый или нет | |
| IgG3 | слабый | |
| Овца | слабый или нет |
Другие связывающие антитела белки
В дополнение к протеину A, другие связывающие иммуноглобулин бактериальные протеины, такие как Белок G, Белок A / G и Белок L все они обычно используются для очистки, иммобилизации или обнаружения иммуноглобулинов.
Роль в патогенезе
Как возбудитель, Золотистый стафилококк использует протеин A, наряду с множеством других протеинов и поверхностных факторов, чтобы способствовать его выживанию и вирулентности. С этой целью протеин А играет многогранную роль:
- Связывая Fc-часть антител, белок A делает их недоступными для опсонинов, тем самым нарушая фагоцитоз бактерий посредством атаки иммунных клеток.
- Белок А способствует соблюдению S. aureus к человеку фактор фон Виллебранда (vWF) -покрытые поверхности, что увеличивает инфекционность бактерий в местах проникновения через кожу.
- Белок А может вызвать воспаление легочной ткани, связываясь с фактор некроза опухоли 1 (TNFR-1) рецепторы. Было показано, что это взаимодействие играет ключевую роль в патогенезе стафилококковой пневмонии.
- Было показано, что белок А ослабляет гуморальный (опосредованный антителами) иммунитет, что, в свою очередь, означает, что люди могут повторно инфицироваться S. aureus поскольку они не могут вызвать сильный антительный ответ.
- Было показано, что белок А способствует образованию биопленок как в том случае, когда белок ковалентно связан со стенкой бактериальной клетки, так и в растворе.[12]
Белок А помогает подавлять поглощение фагоцитами и действует как иммунологическая маскировка. Более высокий уровень протеина А в разных штаммах S. aureus были связаны с носительством этих бактерий через нос.[13]
Мутанты S. aureus не имеющие протеина А более эффективно фагоцитируются in vitro, а мутанты в моделях инфекции имеют пониженную вирулентность.[14]
Производство
Белок А производится и очищается при промышленной ферментации для использования в иммунологии, биологических исследованиях и промышленных применениях (см. Ниже). Природный (или нативный) белок А можно культивировать в Золотистый стафилококк и содержит пять областей связывания гомологичных антител, описанных выше, и С-концевую область для прикрепления к клеточной стенке. Сегодня белок А чаще рекомбинантно продуцируется в кишечная палочка. (Brevibacillus также было показано, что он является эффективным хозяином.[15]) Рекомбинантные версии протеина А также содержат пять гомологичных связывающих доменов антител, но могут различаться в других частях структуры, чтобы облегчить связывание с пористыми субстратами.[16] Также доступны сконструированные версии белка, первой из которых был rProtein A, B4, C-CYS.[17] Спроектированные версии представляют собой мультимеры (обычно тетрамеры, пентамеры или гексамеры) одного домена, который был модифицирован для повышения удобства использования в промышленных приложениях.
Исследование
Белок А часто связан с другими молекулами, такими как флуоресцентный краситель, ферменты, биотин, коллоидное золото или радиоактивный йод без воздействия на сайт связывания антитела. Примеры, в том числе окрашивание протеином A – золотом (PAG), используется в маркировка иммунозолота, белок А, связанный с флуорофором, для иммунофлуоресценции и белок А, связанный с стыковочной цепью ДНК, для визуализации DNA-PAINT.[18] Он также широко используется в сочетании с магнитными, латексными и агароза бусы.
Белок А часто иммобилизуют на твердом носителе и используют в качестве надежного метода очистки общего IgG из сырых белковых смесей, таких как сыворотка или же асцит жидкости или в сочетании с одним из вышеуказанных маркеров для обнаружения наличия антител. Первый пример связывания протеина А с пористым шариком для очистки IgG был опубликован в 1972 году.[19] Иммунопреципитация исследования с протеином А, конъюгированным с шариками, также обычно используются для очистки протеинов или протеиновых комплексов косвенно через антитела против интересующего протеина или протеинового комплекса.
Роль в промышленной очистке антител

Первое упоминание в литературе коммерчески доступной смолы для хроматографии на протеине А появилось в 1976 году.[20] Сегодня хроматографическое разделение с использованием протеина А, иммобилизованного на пористых субстратах, является наиболее широко распространенным методом очистки моноклональные антитела (mAb) из супернатанта культуры клеток.[21] Выбор протеина А в качестве предпочтительного метода обусловлен высокой чистотой и выходом, которые легко и надежно достигаются. Это формирует основу для общей «платформы» очистки антител, которая упрощает производственные операции и сокращает время и усилия, необходимые для разработки процессов очистки.[22] Типичный процесс очистки mAb показан справа. Несмотря на долгую историю использования хроматографии на протеине А для производства антител, этот процесс все еще совершенствуется сегодня. Непрерывная хроматография, точнее периодическая противоточная хроматография, значительно увеличивает производительность стадии очистки.
Рекомендации
- ^ Graille M, Stura EA, Corper AL, Sutton BJ, Taussig MJ, Charbonnier JB, Silverman GJ (май 2000 г.). «Кристаллическая структура домена A белка Staphylococcus aureus в комплексе с Fab-фрагментом человеческого IgM-антитела: структурная основа для распознавания B-клеточных рецепторов и суперантигенной активности». Труды Национальной академии наук Соединенных Штатов Америки. 97 (10): 5399–404. Bibcode:2000PNAS ... 97.5399G. Дои:10.1073 / pnas.97.10.5399. ЧВК 25840. PMID 10805799.
- ^ Idusogie EE, Presta LG, Gazzano-Santoro H, Totpal K, Wong PY, Ultsch M и др. (Апрель 2000 г.). «Картирование сайта связывания C1q на ритуксане, химерном антителе с человеческим Fc IgG1». Журнал иммунологии. 164 (8): 4178–84. Дои:10.4049 / jimmunol.164.8.4178. PMID 10754313.
- ^ Кинер А.Б., Терлоу Л.Т., Кан С., Спидейл Н.А., Кларк С.Х., Каннион К.М. и др. (Февраль 2017). «Протеин A Staphylococcus aureus нарушает иммунитет, опосредованный долгоживущими плазматическими клетками». Журнал иммунологии. 198 (3): 1263–1273. Дои:10.4049 / jimmunol.1600093. ЧВК 5266639. PMID 28031339.
- ^ Verwey WF (апрель 1940 г.). «Типоспецифический антигенный белок, полученный из стафилококка». Журнал экспериментальной медицины. 71 (5): 635–44. Дои:10.1084 / jem.71.5.635. ЧВК 2135093. PMID 19870987.
- ^ Дженсен, К. (1958). «Нормально встречающееся антитело к стафилококку в сыворотке крови человека». Acta Pathol. Microbiol. Сканд. 44 (4): 421–428. Дои:10.1111 / j.1699-0463.1958.tb01093.x. PMID 17504410.
- ^ Диксон, Фрэнк Дж. (11 августа 1982 г.). ДОСТИЖЕНИЯ В ИММУНОЛОГИИ. Академическая пресса. п.158.
- ^ Löfkvist T, Sjöquist J (ноябрь 1962 г.). «Химический и серологический анализ препаратов антигена из золотистого стафилококка». Acta Pathologica et Microbiologica Scandinavica. 56 (3): 295–304. Дои:10.1111 / j.1699-0463.1962.tb04908.x.
- ^ Гров А, Миклестад Б, Уединг П. (1964). «Иммунохимические исследования антигенных препаратов из золотистого стафилококка. 1. Выделение и химическая характеристика антигена А». Acta Pathologica et Microbiologica Scandinavica. 61 (4): 588–96. Дои:10.1111 / apm.1964.61.4.588. PMID 14185494.
- ^ Deisenhofer J (апрель 1981 г.). «Кристаллографическое уточнение и атомные модели человеческого Fc-фрагмента и его комплекса с фрагментом B белка A из Staphylococcus aureus с разрешением 2,9 и 2,8 A». Биохимия. 20 (9): 2361–70. Дои:10.1021 / bi00512a001. PMID 7236608.
- ^ Сассо EH, Сильверман GJ, Манник M (сентябрь 1991). «Человеческие IgA и IgG F (ab ') 2, которые связываются со стафилококковым белком А, относятся к подгруппе VHIII». Журнал иммунологии. 147 (6): 1877–83. PMID 1909733.
- ^ Аффинная хроматография (PDF). Vol. 1: Антитела (AF ed.). GE Healthcare. 2016. с. 48.
- ^ "Швейцарский армейский нож патогена". Мелочи учтены. Получено 2016-08-25.
- ^ Мутукришнан Г., Куинн Г.А., Ламерс Р.П., Диаз К., Коул А.Л., Чен С., Коул А.М. (апрель 2011 г.). «Экзопротеом Staphylococcus aureus раскрывает предполагаемые факторы носительства». Журнал протеомных исследований. 10 (4): 2064–78. Дои:10.1021 / pr200029r. ЧВК 3070068. PMID 21338050.
- ^ Goodyear CS, Silverman GJ (май 2003 г.). «Смерть от суперантигена В-клеток: In vivo VH-нацеленная апоптотическая супраклональная делеция В-клеток стафилококковым токсином». Журнал экспериментальной медицины. 197 (9): 1125–39. Дои:10.1084 / jem.20020552. ЧВК 2193973. PMID 12719481.
- ^ Косуги А., JP, Ядзима К., JP (18 ноября 2014 г.), Патент США: 8889389 - Способ получения протеина А-подобного протеина с использованием бактерии рода Brevibacillus., получено 2016-08-26
- ^ "usp31nf26s1_c130". www.uspbpep.com. Общие главы: АТРИБУТЫ КАЧЕСТВА БЕЛКА А. Получено 2016-08-26.
- ^ Hober S (12 июня 2012 г.), Патент США: 8198404 - Мутировавший иммуноглобулин-связывающий белок., получено 2016-08-26
- ^ Schlichthaerle T, Ganji M, Auer A, Kimbu Wade O, Jungmann R (апрель 2019 г.). «Связующие антитела, полученные из бактерий, как небольшие адаптеры для микроскопии DNA-PAINT». ChemBioChem. 20 (8): 1032–1038. Дои:10.1002 / cbic.201800743. PMID 30589198.
- ^ Hjelm H, Hjelm K, Sjöquist J (ноябрь 1972 г.). «Белок А из золотистого стафилококка. Его выделение с помощью аффинной хроматографии и его использование в качестве иммуносорбента для выделения иммуноглобулинов». Письма FEBS. 28 (1): 73–6. Дои:10.1016 / 0014-5793 (72) 80680-X. PMID 4630462. S2CID 8733702.
- ^ Скварил Ф. (1976-10-01). «Вопрос о специфичности связывания подклассов человеческого IgG с протеином A-сефарозой». Иммунохимия. 13 (10): 871–872. Дои:10.1016/0019-2791(76)90188-9. PMID 12109.
- ^ Шукла А.А., Хаббард Б., Трессел Т., Гухан С., Низкий Д. (март 2007 г.). «Последующая обработка моноклональных антител - применение платформенных подходов». Журнал хроматографии. B, Аналитические технологии в биомедицине и науках о жизни. Производство поликлональных и моноклональных антител, очистка, аналитика процессов и продуктов. 848 (1): 28–39. Дои:10.1016 / j.jchromb.2006.09.026. PMID 17046339.
- ^ Лю Х.Ф., Ма Дж., Винтер К., Байер Р. (01.09.2010). «Разработка процессов восстановления и очистки для получения моноклональных антител». mAbs. 2 (5): 480–99. Дои:10.4161 / мабс.2.5.12645. ЧВК 2958570. PMID 20647768.
