Коллоидное золото - Colloidal gold
Эта научная статья требует дополнительных цитаты к вторичные или третичные источники (Август 2017 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |

| Часть серии статей о |
| Наноматериалы |
|---|
 |
| Углеродные нанотрубки |
| Фуллерены |
| Другой наночастицы |
| Наноструктурированные материалы |
|
Коллоидное золото это соль или же коллоидная суспензия из наночастицы из золото в жидкости, обычно в воде.[1] Коллоид обычно имеет интенсивный красный цвет (для сферических частиц менее 100нм ) или синий / фиолетовый (для более крупных сферических частиц или наностержни ).[2]Благодаря их оптический, электронным и молекулярным свойствам, наночастицы золота являются предметом серьезных исследований с множеством потенциальных или обещанных применений в самых разных областях, включая электронная микроскопия, электроника, нанотехнологии, материаловедение, и биомедицина.[3][4][5][6]
Свойства наночастиц коллоидного золота и, следовательно, их потенциальное применение сильно зависят от их размера и формы.[7] Например, стержневидные частицы имеют как поперечные, так и продольные поглощение пик, и анизотропия формы влияет на их самосборка.[8]
История

Используются с древних времен как метод витраж коллоидное золото использовалось в 4 веке. Кубок Ликурга, который меняет цвет в зависимости от расположения источника света.[9][10]
Вовремя Средний возраст, растворимое золото, раствор, содержащий золотая соль, имел репутацию лечебного свойства при различных заболеваниях. В 1618 г. Фрэнсис Энтони, философ и медик, опубликовал книгу под названием Panacea Aurea, sive tractatus duo de ipsius Auro Potabili[11] (Латинское: золотое зелье или два лечения питьевой золото). В книге представлена информация об образовании коллоидного золота и его медицинских применениях. Примерно полвека спустя английский ботаник Николас Калпеппер опубликовал книгу в 1656 г., Трактат о Aurum Potabile,[12] исключительно обсуждение медицинских применений коллоидного золота.
В 1676 г. Иоганн Кункель Немецкий химик опубликовал книгу по изготовлению витражей. В его книге Ценные наблюдения или замечания о фиксированных и летучих солях - Auro и Argento Potabile, Spiritu Mundi и т.п.,[13] Кункель предположил, что розовый цвет Aurum Potabile произошел от небольших частиц металлического золота, невидимых человеческому глазу. В 1842 г. Джон Гершель изобрел фотографический процесс, названный хризотипом (от греческого χρῡσός, что означает «золото»), который использовал коллоидное золото для записи изображений на бумаге.
Современная научная оценка коллоидного золота не началась до Майкла Фарадея работа в 1850-х гг.[14][15] В 1856 г. в подвальной лаборатории г. Королевский институт Фарадей случайно создал раствор рубиново-красного цвета, прикрепляя кусочки сусального золота к предметным стеклам микроскопа.[16] Поскольку он уже интересовался свойствами света и материи, Фарадей продолжил исследование оптических свойств коллоидного золота. В 1857 году он приготовил первый чистый образец коллоидного золота, который назвал «активированным золотом». фосфор к уменьшать раствор хлорида золота. Коллоидное золото, полученное Фарадеем 150 лет назад, все еще оптически активным. Долгое время состав «рубинового» золота был неясным. Несколько химиков заподозрили, что это золото. банка соединение, в связи с его приготовлением.[17][18] Фарадей признал, что цвет на самом деле был обусловлен миниатюрным размером частиц золота. Он отметил рассеяние света свойства взвешенных микрочастиц золота, что теперь называется Эффект Фарадея-Тиндаля.[15]
В 1898 г. Ричард Адольф Жигмонди приготовили первое коллоидное золото в разбавленном растворе.[19] Помимо Жигмонди, Теодор Сведберг, кто придумал ультрацентрифугирование, и Густав Мие, который предоставил теория рассеяния и поглощения сферическими частицами, также интересовались синтезом и свойствами коллоидного золота.[8][20]
С развитием различных аналитических технологий в 20-м веке исследования наночастиц золота ускорились. Передовые методы микроскопии, такие как атомно-силовая микроскопия и электронная микроскопия, внесли наибольший вклад в исследования наночастиц. Благодаря сравнительно простому синтезу и высокой стабильности, различные частицы золота были изучены для их практического использования. Различные типы наночастиц золота уже используются во многих отраслях промышленности, например в электронике.
Физические свойства
Оптический

Коллоидное золото веками использовалось художниками из-за взаимодействия наночастиц с видимым светом. Наночастицы золота поглощают и рассеивают свет[21] Цвета варьируются от ярко-красного до синего, до черного и, наконец, до прозрачного и бесцветного, в зависимости от размера, формы, местного показателя преломления и агрегатного состояния. Эти цвета возникают из-за явления, называемого локализованный поверхностный плазмонный резонанс (LSPR), при котором электроны проводимости на поверхности наночастицы колеблются в резонансе с падающим светом.
Влияние размера
Как правило, длина волны поглощаемого света увеличивается с увеличением размера наночастиц.[22] Например, псевдосферические наночастицы золота диаметром ~ 30 нм имеют пик поглощения LSPR при ~ 530 нм.[22][требуется разъяснение ]
Влияние местного показателя преломления
Изменения видимого цвета раствора наночастиц золота также могут быть вызваны средой, в которой находится суспензия коллоидного золота.[23][24] Оптические свойства наночастиц золота зависят от показателя преломления вблизи поверхности наночастиц, поэтому как молекулы, непосредственно прикрепленные к поверхности наночастиц (то есть лиганды наночастиц), так и / или наночастицы растворитель оба могут влиять на наблюдаемые оптические характеристики.[23] По мере увеличения показателя преломления вблизи поверхности золота NP LSPR будет сдвигаться в сторону более длинных волн.[24] Помимо среды растворителя, пик вымирания можно настроить путем покрытия наночастиц непроводящей оболочкой, такой как диоксид кремния, биомолекулы или оксид алюминия.[25]
Эффект агрегации
Когда наночастицы золота объединяются, оптические свойства частицы изменяются, потому что эффективный размер, форма и диэлектрик среда все меняется.[26]
Медицинские исследования
Эта секция нужно больше медицинские справки за проверка или слишком сильно полагается на основные источники. (Август 2017 г.) |
Электронная микроскопия
Коллоидное золото и его различные производные уже давно являются одними из наиболее широко используемых меток для антигенов в биологических электронная микроскопия.[27][28][29][30][31] Частицы коллоидного золота могут быть прикреплены ко многим традиционным биологическим зондам, таким как антитела, лектины, суперантигены, гликаны, нуклеиновые кислоты,[32] и рецепторы. Частицы разных размеров легко различимы на электронных микрофотографиях, что позволяет проводить одновременные эксперименты с множественными метками.[33]
В дополнение к биологическим зондам, наночастицы золота могут быть перенесены на различные минеральные субстраты, такие как слюда, монокристаллический кремний и атомарно плоское золото (III), для наблюдения под атомно-силовой микроскопией (АСМ).[34]
Система доставки лекарств
Наночастицы золота можно использовать для оптимизации биораспределения лекарств в пораженных органах, тканях или клетках, чтобы улучшить и направить доставку лекарств.[35][36]Доставка лекарств, опосредованная наночастицами, возможна только в том случае, если распределение лекарств в остальном неадекватно. Эти случаи включают нацеливание на нестабильные (белки, миРНК, ДНК ), доставка в трудные участки (мозг, сетчатка, опухоли, внутриклеточные органеллы) и лекарства с серьезными побочными эффектами (например, противораковые средства). Характеристики наночастиц зависят от размера и функциональности поверхности частиц. Кроме того, высвобождение лекарственного средства и дезинтеграция частиц могут варьироваться в зависимости от системы (например, биоразлагаемых полимеров, чувствительных к pH). Оптимальная система доставки нанопрепаратов гарантирует, что активное лекарство доступно в месте действия в течение правильного времени и продолжительности, а их концентрация должна быть выше минимальной эффективной концентрации (MEC) и ниже минимальной токсической концентрации (MTC).[37]
Наночастицы золота исследуются в качестве носителей для таких лекарств, как Паклитаксел.[38] Прием гидрофобных препаратов требует молекулярная инкапсуляция и обнаружено, что наноразмерные частицы особенно эффективны в предотвращении ретикулоэндотелиальной системы.
Обнаружение опухоли
В исследованиях рака коллоидное золото может использоваться для нацеливания на опухоли и обеспечения обнаружения с помощью SERS (Рамановская спектроскопия с усилением поверхности ) in vivo. Эти золотые наночастицы окружены рамановскими репортерами, которые обеспечивают световое излучение, которое более чем в 200 раз ярче, чем квантовые точки. Было обнаружено, что рамановские репортеры стабилизировались, когда наночастицы инкапсулировались тиол-модифицированным полиэтиленгликоль Пальто. Это обеспечивает совместимость и распространение in vivo. Чтобы целенаправленно воздействовать на опухолевые клетки, полиэтиленгилированный частицы золота конъюгированы с антителом (или фрагментом антитела, таким как scFv), например, против рецептор эпидермального фактора роста, который иногда сверхэкспрессируется в клетках определенных типов рака. Используя SERS, эти пегилированные наночастицы золота могут затем определить местоположение опухоли.[39]
Наночастицы золота накапливаются в опухолях из-за неплотности сосудистой сети опухоли и могут использоваться в качестве контрастных агентов для улучшенной визуализации в системе оптической томографии с временным разрешением с использованием короткоимпульсных лазеров для обнаружения рака кожи на модели мыши. Обнаружено, что внутривенно введенные сферические наночастицы золота расширяли временной профиль отраженных оптических сигналов и усиливали контраст между окружающей нормальной тканью и опухолями.[40]

Генная терапия
Золотые наночастицы показали потенциал в качестве носителей внутриклеточной доставки олигонуклеотидов миРНК с максимальным терапевтическим эффектом.

Наночастицы золота демонстрируют потенциал в качестве внутриклеточных средств доставки антисмысловой олигонуклеотиды (одноцепочечные и двухцепочечные ДНК), обеспечивая защиту от внутриклеточных нуклеазы и простота функционализации для выборочного нацеливания.[41]
Фототермические агенты
Золотые наностержни исследуются как фототермические агенты для применения in-vivo. Золотые наностержни представляют собой стержневые наночастицы золота, соотношение сторон которых настраивает полосу поверхностного плазмонного резонанса (SPR) от видимой до ближней инфракрасной длины волны. Полное поглощение света на ППР складывается как из поглощения, так и из рассеяния. Для наностержней с меньшим осевым диаметром (~ 10 нм) преобладает поглощение, тогда как для наностержней с большим осевым диаметром (> 35 нм) может преобладать рассеяние. Как следствие, для исследований in vivo золотые наностержни малого диаметра используются в качестве фототермических преобразователей ближнего инфракрасного света из-за их высокого поперечного сечения поглощения.[42] Поскольку свет в ближнем инфракрасном диапазоне легко проходит через кожу и ткани человека, эти наностержни можно использовать в качестве компонентов для удаления рака и других целей. При покрытии полимерами золотые наностержни циркулируют in vivo с периодом полураспада более 6 часов, временем пребывания в организме около 72 часов и практически не поглощаются какими-либо внутренними органами, кроме печени.[43]
Несмотря на неоспоримый успех золотых наностержней в качестве фототермических агентов в доклинические исследования, они еще не получили одобрения для клинического использования, потому что размер превышает допустимый почечная экскреция порог.[44][45] В 2019 году первый NIR-поглощающий плазмонный сообщалось о сверхмалой в нано архитектуре, которые совместно сочетают: (i) подходящий фототермический преобразование для гипертермия лечения, (ii) возможность нескольких фототермический лечения и (iii) почечная экскреция строительных блоков после терапевтического воздействия.[46]
Усилитель дозы лучевой терапии
Значительный интерес был проявлен к использованию золота и других наночастиц, содержащих тяжелые атомы, для увеличения дозы, доставляемой опухолям.[47] Поскольку наночастицы золота захватываются опухолями в большей степени, чем близлежащие здоровые ткани, доза избирательно увеличивается. Биологическая эффективность этого типа терапии, по-видимому, связана с локальным отложением дозы облучения вблизи наночастиц.[48] Этот механизм такой же, как в тяжелая ионная терапия.
Обнаружение токсичного газа
Исследователи разработали простые и недорогие методы обнаружения на месте сероводород ЧАС
2S присутствуют в воздухе на основе антиагрегации наночастиц золота (AuNP). Растворение ЧАС
2S в слабый щелочной буферный раствор приводит к образованию HS-, который может стабилизировать AuNP и гарантировать, что они сохраняют свой красный цвет, что позволяет визуально определять токсические уровни ЧАС
2S.[49]
Биосенсор на основе наночастиц золота
Наночастицы золота включены в биосенсоры для повышения его стабильности, чувствительности и избирательности.[50] Свойства наночастиц, такие как малый размер, высокое отношение поверхности к объему и высокая поверхностная энергия, позволяют иммобилизовать широкий спектр биомолекул. Золотая наночастица, в частности, может также действовать как «электронный провод» для переноса электронов, а ее усиливающий эффект на электромагнитный свет позволяет ей действовать как усилители сигнала.[51][52] Основными видами биосенсоров на основе наночастиц золота являются оптические и электрохимические биосенсоры.
Оптический биосенсор

Наночастицы золота улучшают чувствительность оптического сенсора, реагируя на изменение локального показателя преломления. Угол падения света для поверхностного плазмонного резонанса, взаимодействия между световой волной и проводящими электронами в металле, изменяется, когда другие вещества связаны с поверхностью металла.[53][54] Поскольку золото очень чувствительно к диэлектрической проницаемости окружающей среды,[55][56] Связывание аналита могло бы значительно изменить SPR золотых наночастиц и, следовательно, обеспечить более чувствительное обнаружение. Золотая наночастица также может усиливать сигнал SPR.[57] Когда плазмонная волна проходит через золотую наночастицу, плотность заряда в волне и электрон - золото взаимодействуют и приводят к более высокому энергетическому отклику, так называемому взаимодействию электронов.[50] Поскольку аналит и биорецептор теперь связываются с золотом, это увеличивает кажущуюся массу анализируемого вещества и, следовательно, усиливает сигнал.[50]Эти свойства были использованы для создания ДНК-сенсора с 1000-кратной чувствительностью, чем без Au NP.[58] Датчик влажности также был построен путем изменения расстояния между атомами между молекулами с изменением влажности, изменение расстояния также привело бы к изменению LSPR Au NP.[59]
Электрохимический биосенсор
Электрохимический датчик преобразует биологическую информацию в электрические сигналы, которые можно обнаружить. Электропроводность и биосовместимость Au NP позволяют ему действовать как «электронная проволока».[50] Он переносит электрон между электродом и активным центром фермента.[60] Это можно сделать двумя способами: присоединить Au NP к ферменту или к электроду. Монослойный электрод GNP-глюкозооксидазы был сконструирован с использованием этих двух методов.[61] Au NP дает больше свободы в ориентации фермента и, следовательно, более чувствительное и стабильное обнаружение. Au NP также действует как платформа для иммобилизации фермента. Большинство биомолекул денатурируют или теряют активность при взаимодействии с электродом.[50] Биосовместимость и высокая поверхностная энергия Au позволяют ему связываться с большим количеством белка без изменения его активности, что приводит к более чувствительному сенсору.[62][63] Более того, Au NP также катализирует биологические реакции.[64][65] Золотая наночастица размером менее 2 нм показала каталитическая активность к окислению стирола.[66]
Иммунологический биосенсор
Наночастицы золота были покрыты пептиды и гликаны для использования в иммунологических методах обнаружения.[67] Возможность использования гликонаночастиц в ELISA было неожиданным, но этот метод, похоже, обладает высокой чувствительностью и, таким образом, предлагает потенциал для разработки специфических тестов для диагностический идентификация антитела в сыворотках пациентов [68]
Тонкие пленки
Наночастицы золота, покрытые органическими лигандами, такими как молекулы алкантиола, могут самоорганизовываться в большие монослои (> см). Сначала частицы приготавливают в органическом растворителе, таком как хлороформ или толуол, а затем распределяют в монослои либо на жидкой поверхности, либо на твердой подложке. Такие межфазные тонкие пленки наночастиц имеют тесную связь с Ленгмюр-Блоджетт монослои из поверхностно-активных веществ.
Механические свойства монослоев наночастиц широко изучены. Для сфер размером 5 нм, покрытых додекантиолом, модуль Юнга монослоя составляет порядка ГПа.[69] Механика мембран определяется сильными взаимодействиями между оболочками лигандов на соседних частицах.[70] При разрушении пленки растрескиваются перпендикулярно направлению деформации при напряжении разрушения 11 2,6 МПа, что сопоставимо с пленками из сшитых полимеров.[71] Свободно стоящие мембраны из наночастиц демонстрируют жесткость на изгиб порядка 10 эВ, выше, чем предсказывается в теории для пластин из континуума той же толщины, из-за нелокальных микроструктурных ограничений, таких как нелокальная связь вращательных степеней свободы частиц.[72] С другой стороны, обнаружено, что сопротивление изгибу значительно снижается в монослоях наночастиц, которые поддерживаются на границе раздела воздух / вода, возможно, из-за экранирования взаимодействий лигандов во влажной среде.[73]
Химия поверхности
Во многих различных типах синтезов коллоидного золота интерфейс наночастиц могут иметь самые разные характеры - от интерфейса, похожего на самоорганизующийся монослой к неупорядоченной границе без повторяющихся узоров.[74] Помимо интерфейса Au-лиганд, конъюгация межфазных лигандов с различными функциональными части (от небольших органических молекул до полимеров, от ДНК до РНК) обеспечивают коллоидному золоту большую часть его обширных функций.
Обмен / функционализация лиганда
После первоначального синтеза наночастиц лиганды коллоидного золота часто заменяются новыми лигандами, разработанными для конкретных применений. Например, наночастицы золота, полученные с помощью метода Туркевича (или восстановления цитрата), легко вступают в реакцию посредством реакций обмена лигандов из-за относительно слабого связывания между карбоксильными группами и поверхностями наночастиц.[75] Этот обмен лигандами может вызывать конъюгацию с рядом биомолекул от ДНК до РНК, от белков до полимеров (таких как ПЭГ ) увеличить биосовместимость и функциональность. Например, было показано, что лиганды усиливают каталитическая активность посредничеством взаимодействия между адсорбатами и активными поверхностями золота для определенных реакций оксигенации.[76] Обмен лиганда также можно использовать для ускорения фазового переноса коллоидных частиц.[74] Обмен лиганда также возможен с алкан-тиол-арестованными НЧ, полученными методом синтеза типа Бруста, хотя для ускорения отрыва лиганда необходимы более высокие температуры.[77][78] Альтернативный метод дальнейшей функционализации достигается путем конъюгации лигандов с другими молекулами, хотя этот метод может привести к разрушению коллоидной стабильности Au NP.[79]
Удаление лиганда
Во многих случаях, как в различных высокотемпературных каталитических применениях Au, удаление блокирующих лигандов дает более желательные физико-химические свойства.[80] Удаление лигандов из коллоидного золота при поддержании относительно постоянного числа атомов Au на наночастицы Au может быть затруднено из-за тенденции этих голых кластеров к агрегированию. Удаление лигандов частично достижимо, просто смыв все избыточные кэпирующие лиганды, хотя этот метод неэффективен при удалении всего кэпирующего лиганда. Чаще удаление лиганда достигается при высокой температуре или освещении. абляция с последующей стиркой. Альтернативно лиганды могут быть электрохимически травленый выключенный.[81]
Структура поверхности и химическая среда
Точная структура лигандов на поверхности НЧ коллоидного золота влияет на свойства частиц коллоидного золота. Конформации связывания и поверхностная упаковка закрывающих лигандов на поверхности коллоидных наночастиц золота имеют тенденцию сильно отличаться от адсорбции на модели объемной поверхности, в основном из-за высокой кривизны, наблюдаемой на поверхности наночастиц.[74] Границы раздела тиолат-золото на наномасштабе были хорошо изучены, и было обнаружено, что тиолатные лиганды оттягивают атомы Au от поверхности частиц к «штапельным» мотивам, которые имеют значительный характер Thiyl-Au (0).[82][83] С другой стороны, поверхность цитрата-золота относительно менее изучена из-за огромного количества конформаций связывания цитрата с изогнутыми поверхностями золота. Исследование, проведенное в 2014 году, показало, что наиболее предпочтительное связывание цитрата происходит с двумя карбоновыми кислотами, а гидроксильная группа цитрата связывает три поверхностных атома металла.[84]
Здоровье и безопасность
Поскольку наночастицы золота (AuNP) исследуются на предмет адресной доставки лекарств людям, необходимо учитывать их токсичность. По большей части предполагается, что AuNP биосовместимы,[нужна цитата ] но необходимо определить концентрации, при которых они становятся токсичными, и попадают ли эти концентрации в диапазон используемых концентраций. Токсичность можно проверить in vitro и in vivo. В пробирке Результаты токсичности могут варьироваться в зависимости от типа среды для клеточного роста с различными белковыми композициями, метода, используемого для определения клеточной токсичности (здоровье клетки, клеточный стресс, количество клеток, попавших в клетку), а также от лигандов кэпинга в растворе.[85] В естественных условиях оценки могут определять общее состояние здоровья организма (ненормальное поведение, потеря веса, средняя продолжительность жизни), а также тканеспецифическая токсикология (почки, печень, кровь), а также воспаление и окислительные реакции.[85] В пробирке эксперименты более популярны, чем in vivo эксперименты, потому что in vitro эксперименты проще выполнять, чем in vivo эксперименты.[85]
Токсичность и опасности при синтезе
Хотя сами по себе AuNP обладают низкой или незначительной токсичностью,[нужна цитата ] и литература показывает, что токсичность в гораздо большей степени связана с лигандами, чем с самими частицами, их синтез включает в себя опасные химические вещества. Боргидрид натрия, агрессивный реагент, используется для восстановления ионов золота до металлического золота.[86] Ионы золота обычно поступают из хлористоводородная кислота, сильнодействующая кислота.[87] Из-за высокой токсичности и опасности реагентов, используемых для синтеза AuNP, возникла потребность в более «зеленых» методах синтеза.
Токсичность из-за кэпирующих лигандов
Некоторые из кэпирующих лигандов, связанных с AuNP, могут быть токсичными, в то время как другие нетоксичны. В золотых наностержнях (AuNR) было показано, что сильная цитотоксичность связана с CTAB -стабилизированные AuNR в низкой концентрации, но считается, что свободный CTAB был виновником токсичности.[87][88] Модификации, которые покрывают эти AuNR, снижают эту токсичность для клеток рака толстой кишки человека (HT-29), предотвращая десорбцию молекул CTAB из AuNR обратно в раствор.[87]Токсичность лиганда также можно увидеть в AuNP. Было показано, что по сравнению с 90% токсичностью HAuCl4 при той же концентрации, AuNP с карбоксилатными концами нетоксичны.[89] Крупные AuNP, конъюгированные с биотином, цистеином, цитратом и глюкозой, не были токсичными для клеток лейкемии человека (K562 ) для концентраций до 0,25 М.[90] Кроме того, было доказано, что золотые наносферы (AuNS), покрытые цитратом, совместимы с кровью человека и не вызывают агрегацию тромбоцитов или иммунный ответ.[91] Однако было обнаружено, что покрытые цитратом золотые наночастицы размером 8–37 нм смертельно токсичны для мышей, вызывая более короткую продолжительность жизни, тяжелые заболевания, потерю аппетита и веса, обесцвечивание волос и повреждение печени, селезенки и легких; Наночастицы золота накапливаются в селезенке и печени после прохождения определенного участка иммунной системы.[92]Есть смешанные взгляды на полиэтиленгликоль (PEG) -модифицированные AuNP. Было обнаружено, что эти AuNP токсичны для печени мышей при инъекции, вызывая гибель клеток и незначительное воспаление.[93] Однако AuNP, конъюгированные с сополимерами PEG, показали незначительную токсичность в отношении клеток толстой кишки человека (Како-2 ).[94]Токсичность AuNP также зависит от общего заряда лигандов. В определенных дозах AuNS, которые содержат положительно заряженные лиганды, токсичны для клеток почек обезьян (Cos-1), красных кровяных телец человека и E. coli из-за взаимодействия AuNS с отрицательно заряженной клеточной мембраной; Было обнаружено, что AuNS с отрицательно заряженными лигандами нетоксичны для этих видов.[89]В дополнение к ранее упомянутым in vivo и in vitro экспериментов, проводились и другие аналогичные эксперименты. Алкилтиолат-AuNP с концами триметляммониевого лиганда опосредуют перемещение ДНК через мембраны клеток млекопитающих in vitro на высоком уровне, что губительно для этих клеток.[95] Помутнение роговицы у кроликов вылечили in vivo с использованием наночастиц золота, покрытых полиэтилеменимином, которые были трансфицированы геном, который способствует заживлению ран и ингибирует роговицу фиброз.[96]
Токсичность из-за размера наночастиц
Токсичность в определенных системах также может зависеть от размера наночастиц. AuNS размером 1,4 нм оказались токсичными для клеток рака кожи человека (SK-Mel-28), клеток рака шейки матки (HeLa ), мышь фибробласт клетки (L929) и мышь макрофаги (J774A.1), тогда как AuNS размером 0,8, 1,2 и 1,8 нм были менее токсичными в шесть раз, а AuNS 15 нм были нетоксичными.[89] Есть некоторые свидетельства накопления AuNP после инъекции в in vivo исследования, но это очень зависит от размера. Было обнаружено, что 1,8 нм AuNP почти полностью захватываются в легких крыс.[97] Было обнаружено, что AuNP разного размера накапливаются в крови,[98][99] мозг,[98] желудок,[98] поджелудочная железа[98] почки,[98] печень,[98][99] и селезенка.[98][99]
Биобезопасность и биокинетические исследования биоразлагаемых ультрамалых структур-наночастиц продемонстрировали, что наночастицы золота способны предотвращать накопление металла в организмах за счет выхода через почечный путь.[100][101]
Синтез
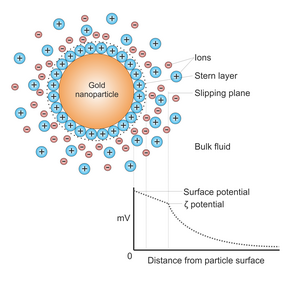
Обычно наночастицы золота производятся в жидкости («жидкие химические методы») путем снижение из хлористоводородная кислота (H [AuCl
4]). Чтобы предотвратить агрегацию частиц, добавляют стабилизаторы. Цитрат действует как восстановитель и коллоидный стабилизатор.
Они могут быть функционализированы различными органическими лигандами для создания органо-неорганических гибридов с расширенной функциональностью.[14]
Метод Туркевича
Этот простой метод был впервые предложен J. Turkevich et al. в 1951 г.[102][103] и усовершенствован Дж. Френсом в 1970-х гг.[104][105] Производит скромно монодисперсный сферические наночастицы золота диаметром около 10–20 нм. Могут быть получены более крупные частицы, но за счет монодисперсности и формы. В этом методе горячий хлористоводородная кислота лечится с цитрат натрия раствор, производящий коллоидное золото. Реакция Туркевича протекает через образование переходного золота. нанопровода. Эти золотые нанопроволоки ответственны за темный вид реакционного раствора, прежде чем он станет рубиново-красным.[106]
Укупорочные агенты
Укупорочный агент используется во время синтеза наночастиц для подавления роста и агрегации частиц. Химикат блокирует или снижает реактивность на периферии частицы - хороший укупоривающий агент имеет высокое сродство к новым ядрам.[107] Цитрат-ионы или дубильная кислота действуют как восстанавливающий агент и как защитный агент.[108][109] Чем меньше цитрат натрия, тем больше частицы.
Метод Бруста-Шиффрина
Этот метод был открыт Брюстом и Шиффрином в начале 1990-х годов.[110] и может быть использован для производства наночастиц золота в органические жидкости которые обычно не смешивающийся с водой (как толуол ). Это связано с реакцией хлорауриновая кислота решение с бромид тетраоктиламмония (TOAB) решение в толуол и борогидрид натрия как антикоагулянт и восстановитель соответственно.
Здесь наночастицы золота будут около 5–6 нм.[111] NaBH4 - восстановитель, а TOAB - одновременно катализатор межфазного переноса и стабилизирующий агент.
TOAB не связывается с наночастицами золота особенно сильно, поэтому раствор будет постепенно агрегироваться в течение примерно двух недель. Чтобы предотвратить это, можно добавить более сильное связующее, например тиол (особенно, алкантиолы ), которое связывается с золотом, образуя почти постоянный раствор.[112][113] Наночастицы золота, защищенные алкантиолом, можно осаждать, а затем повторно растворять. Тиолы являются лучшими связующими агентами, потому что существует сильное сродство к связям золото-сера, которые образуются, когда два вещества реагируют друг с другом.[114] Тетрадодекантиол - обычно используемый сильный связывающий агент для синтеза более мелких частиц.[115]Некоторое количество агента фазового переноса может оставаться связанным с очищенными наночастицами, что может повлиять на физические свойства, такие как растворимость. Чтобы удалить как можно больше этого агента, наночастицы должны быть дополнительно очищены путем экстракция Сокслета.
Метод Перро
Этот подход, открытый Перро и Чаном в 2009 году,[116] использует гидрохинон для уменьшения HAuCl4 в водном растворе, содержащем зародыши наночастиц золота размером 15 нм. Этот метод синтеза на основе затравок аналогичен тому, который используется при проявке фотопленки, при котором зерна серебра внутри пленки растут за счет добавления восстановленного серебра на их поверхность. Точно так же наночастицы золота могут действовать вместе с гидрохиноном, катализируя восстановление ионного золота на своей поверхности. Присутствие стабилизатора, такого как цитрат, приводит к контролируемому осаждению атомов золота на частицах и их росту. Обычно семена наночастиц получают цитратным методом. Гидрохиноновый метод дополняет метод Френса,[104][105] поскольку он расширяет диапазон размеров монодисперсных сферических частиц, которые могут быть получены. В то время как метод Френса идеален для частиц размером 12–20 нм, гидрохиноновый метод может производить частицы размером не менее 30–300 нм.
Метод Мартина
Этот простой метод, открытый Мартином и Эа в 2010 году,[117] генерирует в воде почти монодисперсные «голые» наночастицы золота. Точный контроль стехиометрии восстановления путем регулирования соотношения NaBH4-NaOH в HAuCl4Ионы -HCl в «сладкой зоне», наряду с нагревом, позволяют воспроизводить настройку диаметра в пределах 3–6 нм. Водные частицы коллоидно стабильны из-за их высокого заряда из-за избытка ионов в растворе. Эти частицы могут быть покрыты различными гидрофильными функциональными группами или смешаны с гидрофобными лигандами для применения в неполярных растворителях. В неполярных растворителях наночастицы остаются сильно заряженными и самоорганизуются на жидких каплях с образованием двумерных монослойных пленок монодисперсных наночастиц.
Нанотехнологические исследования
Bacillus licheniformis могут быть использованы для синтеза золотых нанокубов размером от 10 до 100 нанометров.[118] Наночастицы золота обычно синтезируются при высоких температурах в органических растворителях или с использованием токсичных реагентов. Бактерии производят их в гораздо более мягких условиях.
Для частиц размером более 30 нм контроль размера частиц с помощью низкой полидисперсности сферических наночастиц золота остается сложной задачей. Чтобы обеспечить максимальный контроль над структурой НЧ, Наварро и его сотрудники использовали модифицированную процедуру Туркевича-Френса с использованием ацетилацетоната натрия в качестве восстановителя и цитрата натрия в качестве стабилизатора.[119]
Сонолиз
Другой метод экспериментального получения золотых частиц - это сонолиз. Первый метод такого типа был изобретен Байджентом и Мюллером.[120] Эта работа впервые использовала ультразвук для обеспечения энергией задействованных процессов и позволила создать частицы золота диаметром менее 10 нм. В другом методе с использованием ультразвука реакция водного раствора HAuCl4 с глюкоза,[121] то восстановители гидроксильные радикалы и сахар пиролиз радикалы (образуются на границе раздела между схлопывающимися полостями и объемной водой), а полученная морфология - это наноленты шириной 30–50 нм и длиной в несколько микрометров. Эти ленты очень гибкие и могут изгибаться под углом более 90 °. Когда глюкоза заменяется циклодекстрин (олигомер глюкозы), получаются только сферические частицы золота, что позволяет предположить, что глюкоза важна для направления морфологии к ленте.
Блок-сополимерный метод
Сакай и др. Разработали экономичную, экологически безопасную и быструю методологию синтеза наночастиц золота с использованием блок-сополимера.[122] В этой методологии синтеза блок-сополимер играет двойную роль восстанавливающего агента, а также стабилизирующего агента. Формирование наночастиц золота включает три основных этапа: восстановление иона соли золота блок-сополимерами в растворе и образование кластеров золота, адсорбция блок-сополимеров на кластерах золота и дальнейшее восстановление ионов соли золота на поверхности этих кластеров золота для ступенчатый рост частиц золота и, наконец, его стабилизация блок-сополимерами. Но этот метод обычно имеет ограниченный выход (концентрацию наночастиц), который не увеличивается с увеличением концентрации соли золота. Ray et al.[123] улучшил этот метод синтеза, увеличив выход наночастиц во много раз при температуре окружающей среды.
Смотрите также
Рекомендации
- ^ Волиани, Валерио (2020-04-20). Золотые наночастицы: введение в синтез, свойства и применение. Де Грюйтер. Дои:10.1515/9781501511455. ISBN 978-1-5015-1145-5.
- ^ Сапсфорд К.Э., Алгар В.Р., Берти Л., Джеммилл К.Б., Кейси Б.Дж., О Е., Стюарт М.Х., Мединц, Иллинойс (март 2013 г.). «Функционализация наночастиц с помощью биологических молекул: разработка химии, которая способствует нанотехнологиям». Химические обзоры. 113 (3): 1904–2074. Дои:10.1021 / cr300143v. PMID 23432378.
- ^ Ян X, Ян М., Пан Б., Вара М., Ся Й (октябрь 2015 г.). «Золотые наноматериалы в работе в биомедицине». Химические обзоры. 115 (19): 10410–88. Дои:10.1021 / acs.chemrev.5b00193. PMID 26293344.
- ^ Малвани П. (2003). Красота и элегантность нанокристаллов: как невидимые мелкие частицы будут окрашивать и формировать наше будущее (Отчет). Мельбурнский университет. Архивировано из оригинал на 2004-10-28.
- ^ Рао К.Н., Кулькарни Г.У., Томас П.Дж., Эдвардс П.П. (2000). «Металлические наночастицы и их сборки». Обзоры химического общества. 29 (1): 27–35. Дои:10.1039 / A904518J. S2CID 59025862.
- ^ Dreaden EC, Alkilany AM, Huang X, Murphy CJ, El-Sayed MA (апрель 2012 г.). «Золотой век: наночастицы золота для биомедицины». Обзоры химического общества. 41 (7): 2740–79. Дои:10.1039 / c1cs15237h. ЧВК 5876014. PMID 22109657.
- ^ Цзэн С., Юн К.Т., Рой И., Динь XQ, Ю Икс, Луан Ф (2011). «Обзор функционализированных наночастиц золота для биосенсорных приложений» (PDF). Плазмоника. 6 (3): 491–506. Дои:10.1007 / s11468-011-9228-1. S2CID 34796473.
- ^ а б Шарма В., Парк К., Сринивасарао М. (2009). «Коллоидная дисперсия золотых наностержней: исторический фон, оптические свойства, опосредованный затравкой синтез, разделение форм и самосборка». Отчеты по материаловедению и инженерии. 65 (1–3): 1–38. Дои:10.1016 / j.mser.2009.02.002.
- ^ "Кубок Ликурга". британский музей. Получено 2015-12-04.
- ^ Фристоун I, Микс Н., Сакс М., Хиггит С. (2007). "Кубок Ликурга - римская нанотехнология". Золотой бюллетень. 40 (4): 270–277. Дои:10.1007 / BF03215599.
- ^ Антоний Ф (1618). Panacea aurea sive Tractatus duo de ipsius auro potabili. Ex Bibliopolio Frobeniano.
- ^ Калпепер Н. (1657). Трактат г-на Калпеппера об aurum potabile, являющийся описанием тройственного мира, а именно. элементарный небесный интеллектуал, содержащий знания, необходимые для изучения герметической философии. Честно написано им при жизни и после его смерти, опубликовано его женой.. Лондон.
- ^ Kunckel von Löwenstern J (1678). Компания Utiles наблюдала за живыми анимациями салибуса fixis et volatilibus, auro et argento potabili (т. Д.). Австрия: Вильсон.
- ^ а б Редди VR (июль 2006 г.). «Наночастицы золота: синтез и применение». Synlett. 2006 (11): 1791–2. Дои:10.1055 / с-2006-944219.
- ^ а б Фарадей М (январь 1857 г.). "Бейкерская лекция: экспериментальные отношения золота (и других металлов) к свету". Философские труды Лондонского королевского общества. 147: 145–181. Bibcode:1857РСПТ..147..145Ф. Дои:10.1098 / рстл.1857.0011.
- ^ "Золотые коллоиды Майкла Фарадея | Королевский институт: здесь живет наука". www.rigb.org. Получено 2015-12-04.
- ^ Гей-Люссак (1832 г.). "Ueber den Cassius'schen Goldpurpur". Annalen der Physik. 101 (8): 629–630. Bibcode:1832AnP ... 101..629G. Дои:10.1002 / andp.18321010809.
- ^ Берцелиус Дж. Дж. (1831 г.). "Ueber den Cassius 'schen Goldpurpur". Annalen der Physik. 98 (6): 306–308. Bibcode:1831АнП .... 98..306Б. Дои:10.1002 / andp.18310980613.
- ^ Жигмонди Р. (11 декабря 1926 г.). «Свойства коллоидов» (PDF). Нобелевский фонд. Получено 2009-01-23.
- ^ Цзэн С., Ю Х, Ло В., Чжан И, Ху Р, Динь Икс, Хо Х, Юн К. (2013). «Зависимость от размера поверхностного плазмонного резонанса, усиленного наночастицами золота, на основе измерения дифференциальной фазы». Датчики и исполнительные механизмы B: химические. 176: 1128–1133. Дои:10.1016 / j.snb.2012.09.073.
- ^ Андерсон М.Л., Моррис Калифорния, Страуд Р.М., Мерцбахер К.И., Ролисон Д.Р. (1 февраля 1999 г.). "Аэрогели коллоидного золота: получение, свойства и характеристика". Langmuir. 15 (3): 674–681. Дои:10.1021 / la980784i.
- ^ а б Линк С., Эль-Сайед М.А. (1 мая 1999 г.). «Зависимость плазмонного поглощения наночастиц коллоидного золота от размера и температуры». Журнал физической химии B. 103 (21): 4212–4217. CiteSeerX 10.1.1.596.6328. Дои:10.1021 / jp984796o.
- ^ а б Гош С.К., Нат С., Кунду С., Эсуми К., Пал Т. (2004-09-01). «Влияние растворителей и лигандов на локализованный поверхностный плазмонный резонанс (LSPR) золотых коллоидов». Журнал физической химии B. 108 (37): 13963–13971. Дои:10.1021 / jp047021q.
- ^ а б Андервуд С., Малвани П. (1994-10-01). «Влияние показателя преломления раствора на цвет коллоидов золота». Langmuir. 10 (10): 3427–3430. Дои:10.1021 / la00022a011.
- ^ Син С., Тан Л. Х., Ян М, Пан М, Ур Й, Тан Ц, Ян И, Чен Х (2009-05-12). «Строго контролируемые структуры ядро / оболочка: настраиваемые проводящие полимерные оболочки на наночастицах и наноцепях золота». Журнал химии материалов. 19 (20): 3286. Дои:10.1039 / b900993k. S2CID 96293198.
- ^ Гош СК, Пал Т. (ноябрь 2007 г.). «Эффект межчастичного взаимодействия на поверхностном плазмонном резонансе наночастиц золота: от теории к приложениям». Химические обзоры. 107 (11): 4797–862. Дои:10.1021 / cr0680282. PMID 17999554. S2CID 46326525.
- ^ Хорисбергер М., Россет Дж. (Апрель 1977 г.). «Коллоидное золото, полезный маркер для просвечивающей и сканирующей электронной микроскопии». Журнал гистохимии и цитохимии. 25 (4): 295–305. Дои:10.1177/25.4.323352. PMID 323352.
- ^ Электронная микроскопия: принципы и методы для биологов (2-е изд.). Джонс и Бартлетт. Октябрь 1998 г. ISBN 978-0-7637-0192-5.
- ^ Хантер Э.Е. (сентябрь 1993 г.). Практическая электронная микроскопия: иллюстрированное руководство для начинающих (2-е изд.). Издательство Кембриджского университета. ISBN 978-0-521-38539-8.
- ^ Электронная микроскопия: методы и протоколы. Методы молекулярной биологии (2-е изд.). Humana Press. Февраль 2007 г. ISBN 978-1-58829-573-6.
- ^ Романо Е.Л., Романо М. (1977). «Стафилококковый белок, связанный с коллоидным золотом: полезный реагент для мечения участков антиген-антитело в электронной микроскопии». Иммунохимия. 14 (9–10): 711–715. Дои:10.1016 / 0019-2791 (77) 90146-X.
- ^ Fetni R, Drouin R, Lemieux N, Messier PE, Richer CL (декабрь 1991 г.). «Одновременная визуализация полос хромосом и сигнала гибридизации с использованием метки коллоидным золотом в электронной микроскопии». Труды Национальной академии наук Соединенных Штатов Америки. 88 (23): 10916–20. Bibcode:1991PNAS ... 8810916F. Дои:10.1073 / pnas.88.23.10916. ЧВК 53043. PMID 1961763.
- ^ Kasamatsu H, Lin W, Edens J, Revel JP (июль 1983 г.). «Визуализация антигенов, прикрепленных к каркасу цитоскелета в клетках животных: совместная локализация полипептида обезьяньего вируса 40 Vp1 и актина в клетках TC7». Труды Национальной академии наук Соединенных Штатов Америки. 80 (14): 4339–43. Bibcode:1983PNAS ... 80,4339K. Дои:10.1073 / pnas.80.14.4339. ЧВК 384033. PMID 6308616.
Двойная маркировка частицами коллоидного золота разного размера
- ^ Гробельный Дж., ДельРио Ф.В., Прадип Н., Ким Д.И., Хакли В.А., Кук РФ (2011). «Измерение размера наночастиц с помощью атомно-силовой микроскопии». В McNeil SE (ред.). Характеристика наночастиц, предназначенных для доставки лекарств. Humana Press. С. 71–82. ISBN 978-1-60327-198-1.
- ^ Хан Г, Гош П., Ротелло В.М. (февраль 2007 г.). «Функционализированные наночастицы золота для доставки лекарств». Наномедицина. 2 (1): 113–23. Дои:10.2217/17435889.2.1.113. PMID 17716197.
- ^ Хан Г, Гош П., Ротелло В.М. (2007). «Многофункциональные наночастицы золота для доставки лекарств». Биологические применения наночастиц. Достижения экспериментальной медицины и биологии. 620. стр.48–56. Дои:10.1007/978-0-387-76713-0_4. ISBN 978-0-387-76712-3. PMID 18217334.
- ^ Лангер Р. (февраль 2000 г.). «Биоматериалы в доставке лекарств и тканевой инженерии: опыт одной лаборатории». Отчеты о химических исследованиях. 33 (2): 94–101. Дои:10.1021 / ar9800993. PMID 10673317.
- ^ Гибсон Дж. Д., Ханал Б. П., Зубарев Е. Р. (сентябрь 2007 г.). «Наночастицы золота, функционализированные паклитакселом». Журнал Американского химического общества. 129 (37): 11653–61. Дои:10.1021 / ja075181k. PMID 17718495. S2CID 12034022.
- ^ Цянь X, Пэн XH, Ансари Д.О., Инь-Гоэн Q, Чен Г.З., Шин Д.М., Ян Л., Ён А.Н., Ван, доктор медицины, Не С. (январь 2008 г.). «Нацеливание на опухоли in vivo и спектроскопическое обнаружение с помощью поверхностно-усиленных рамановских наночастиц». Природа Биотехнологии. 26 (1): 83–90. Дои:10.1038 / nbt1377. PMID 18157119. S2CID 15309464.
- ^ Саджади А.Ю., Сураткар А.А., Митра К.К., Грейс М.С. (2012). «Короткоимпульсная лазерная система для обнаружения опухолей: введение наночастиц золота увеличивает контраст». J. Nanotechnol. Англ. Med. 3 (2): 021002. Дои:10.1115/1.4007245.
- ^ Гильоханн Д.А., Сеферос Д.С., Пригодич А.Е., Patel PC, Миркин CA. Регулирование генов с помощью конъюгатов поливалентной миРНК-наночастицы. J Am Chem Soc 2009; 131: 2072–2073.
- ^ Mackey MA, Ali MR, Austin LA, Near RD, El-Sayed MA (февраль 2014 г.). «Самый эффективный размер золотых наностержней для плазмонной фототермической терапии: теория и эксперименты in vitro». Журнал физической химии B. 118 (5): 1319–26. Дои:10.1021 / jp409298f. ЧВК 3983380. PMID 24433049.
- ^ Ниидоме Т., Ямагата М., Окамото Ю., Акияма Ю., Такахаши Х., Кавано Т., Катаяма Ю., Ниидоме Ю. (сентябрь 2006 г.). «Золотые наностержни, модифицированные ПЭГ, со скрытым характером для приложений in vivo». Журнал контролируемого выпуска. 114 (3): 343–7. Дои:10.1016 / j.jconrel.2006.06.017. PMID 16876898.
- ^ Кассано, Доменико; Покови-Мартинес, Сальвадор; Волиани, Валерио (17.01.2018). «Подход ультрамалых наноматериалов: возможность использования металлических наноматериалов в клиниках». Биоконъюгат Химия. 29 (1): 4–16. Дои:10.1021 / acs.bioconjchem.7b00664. ISSN 1043-1802. PMID 29186662.
- ^ Вламидис, Илеа; Волиани, Валерио (2018-10-08). «Вывод наночастиц благородных металлов на передний план в терапии рака». Границы биоинженерии и биотехнологии. 6: 143. Дои:10.3389 / fbioe.2018.00143. ISSN 2296-4185. ЧВК 6186777. PMID 30349817.
- ^ Кассано, Доменико; Санти, Мелисса; Д’Аутилия, Франческа; Мапанао, Ана Катрина; Луин, Стефано; Волиани, Валерио (2019). «Фототермический эффект с помощью выделяемых ультрамалых наноразмерных архитектур, чувствительных к ближнему ИК-диапазону». Материалы Horizons. 6 (3): 531–537. Дои:10.1039 / C9MH00096H. ISSN 2051-6347.
- ^ Hainfeld JF, Slatkin DN, Smilowitz HM (сентябрь 2004 г.). «Использование наночастиц золота для улучшения лучевой терапии мышей». Физика в медицине и биологии. 49 (18): N309–15. Дои:10.1088 / 0031-9155 / 49/18 / N03. PMID 15509078. S2CID 28457097.
- ^ МакМахон С.Дж., Хайланд В.Б., Мьюир М.Ф., Колтер Дж.А., Джейн С., Баттерворт К.Т., Шеттино Дж., Диксон Г.Р., Хаунселл А.Р., О'Салливан Дж.М., Приз KM, Херст Д.Г., Каррелл Ф.Дж. (2011). «Биологические последствия наноразмерного распределения энергии около облученных наночастиц с тяжелым атомом». Научные отчеты. 1: 18. Bibcode:2011НатСР ... 1Э..18М. Дои:10.1038 / srep00018. ЧВК 3216506. PMID 22355537.
- ^ Чжан З., Чен З, Ван С., Цюй С, Чен Л. (май 2014 г.). «Визуальное обнаружение сероводорода в воздухе на месте, основанное на повышении стабильности наночастиц золота». Прикладные материалы и интерфейсы ACS. 6 (9): 6300–7. Дои:10.1021 / am500564w. PMID 24754960.
- ^ а б c d е Сюй С (2010). «Биосенсоры на основе наночастиц золота». Золотой бюллетень. 43: 29–41. Дои:10.1007 / BF03214964.
- ^ Ван Дж, Польский Р., Сюй Д. (2001). "Усиленное серебром детектирование гибридизации ДНК с помощью электрохимического удаления коллоидного золота". Langmuir. 17 (19): 5739. Дои:10.1021 / la011002f.
- ^ Ван Дж., Сюй Д., Польский Р. (апрель 2002 г.). «Магнитно-индуцированное твердотельное электрохимическое обнаружение гибридизации ДНК». Журнал Американского химического общества. 124 (16): 4208–9. Дои:10.1021 / ja0255709. PMID 11960439.
- ^ Даниэль MC, Astruc D (январь 2004 г.). «Золотые наночастицы: сборка, супрамолекулярная химия, квантово-размерные свойства и приложения к биологии, катализу и нанотехнологиям». Химические обзоры. 104 (1): 293–346. Дои:10.1021 / cr030698 +. PMID 14719978. S2CID 29293663.
- ^ Ху М., Чен Дж., Ли З.Й., Ау Л., Хартланд Г.В., Ли Х, Маркес М., Ся Й. (ноябрь 2006 г.). «Золотые наноструктуры: разработка их плазмонных свойств для биомедицинских приложений». Обзоры химического общества. 35 (11): 1084–94. Дои:10.1039 / b517615h. PMID 17057837. S2CID 2259806.
- ^ Линк С., Эль-Сайед М.А. (1996). «Спектральные свойства и динамика релаксации поверхностных плазмонных электронных колебаний в наноточках и наностержнях золота и серебра». J. Phys. Chem. B. 103 (40): 8410. Дои:10.1021 / jp9917648. S2CID 40012876.
- ^ Малвани, П. (1996). «Поверхностная плазмонная спектроскопия наноразмерных металлических частиц». Langmuir. 12 (3): 788. Дои:10.1021 / la9502711.
- ^ Lin HY, Chen CT, Chen YC (октябрь 2006 г.). «Обнаружение фосфопептидов с помощью локализованного поверхностного плазменного резонанса наночастиц золота, покрытых диоксидом титана, иммобилизованных на стеклянных подложках». Аналитическая химия. 78 (19): 6873–8. Дои:10.1021 / ac060833t. PMID 17007509. S2CID 13373307.
- ^ He L, Musick MD, Nicewarner SR, Salinas FG (2000). «Коллоидный Au-усиленный поверхностный плазмонный резонанс для сверхчувствительного обнаружения гибридизации ДНК». Журнал Американского химического общества. 122 (38): 9071. Дои:10.1021 / ja001215b.
- ^ Окамото Т., Ямагути И., Кобаяси Т. (2000). «Локальный плазмонный датчик с монослоями коллоида золота, нанесенными на стеклянные подложки». Opt Lett. 25 (6): 372–4. Bibcode:2000 Оптл ... 25..372О. Дои:10.1364 / OL.25.000372. PMID 18059883.
- ^ Браун KR, Фокс П., Натан MJ (1996). "Морфология-зависимая электрохимия Cytochromecat Au Colloid-Modified SnO2Electrodes". Журнал Американского химического общества. 118 (5): 1154. Дои:10.1021 / ja952951w.
- ^ Сяо Ю., Патольски Ф., Кац Э., Хайнфельд Дж. Ф., Виллнер И. (март 2003 г.). ""Погружение в ферменты ": нанопроводка окислительно-восстановительных ферментов золотой наночастицей". Наука. 299 (5614): 1877–81. Bibcode:2003Научный ... 299.1877X. Дои:10.1126 / science.1080664. PMID 12649477. S2CID 40388898.
- ^ Gole A, Dash C, Ramakrishnan V, Sainkar SR, Mandale AB, Rao M, Sastry M (2001). «Конъюгаты пепсин-золото коллоидные: получение, характеристика и ферментативная активность». Langmuir. 17 (5): 1674. Дои:10.1021 / la001164w.
- ^ Голе А, Вьяс С., Фадтаре С., Лачке А., Састри М. (2002). «Исследования по образованию биоконъюгатов эндоглюканазы с коллоидным золотом». Коллоиды и поверхности B: биоинтерфейсы. 25 (2): 129. Дои:10.1016 / s0927-7765 (01) 00301-0.
- ^ Вальден М., Лай X, Гудман Д.В. (сентябрь 1998 г.). «Возникновение каталитической активности кластеров золота на диоксиде титана с появлением неметаллических свойств». Наука. 281 (5383): 1647–50. Bibcode:1998Sci ... 281.1647V. Дои:10.1126 / science.281.5383.1647. PMID 9733505. S2CID 21287894.
- ^ Лу Й, Мэй ММ, Хан Л, Чжун Си Джей (2001). «Сборка наночастиц сплава золота и платины как катализатор электроокисления метанола». Химические коммуникации. 2001 (5): 473. Дои:10.1039 / b008669j.
- ^ Тернер М, Головко В.Б., Воган О.П., Абдулкин П., Беренгер-Мерсия А., Тихов М.С., Джонсон Б.Ф., Ламберт Р.М. (август 2008 г.). «Селективное окисление кислородом с помощью катализаторов наночастиц золота, полученных из кластеров из 55 атомов». Природа. 454 (7207): 981–3. Bibcode:2008Натура.454..981Т. Дои:10.1038 / природа07194. PMID 18719586. S2CID 4355469.
- ^ Марради М, Кьодо Ф, Гарсия I, Пенадес С (2013). «Гликонаночастицы как многофункциональные и мультимодальные углеводные системы». Chem. Soc. Rev. 42 (11): 4728–45. Дои:10.1039 / C2CS35420A. PMID 23288339.
- ^ Чиодо Ф., Марради М., Тефсен Б., Снайппе Х., ван Дай I, Пенадес С. (2013). «Высокочувствительное определение белков, связывающих углеводы, в твердофазном твердофазном анализе ELISA на основе поливалентных гликонаночастиц». PLOS ONE. 8 (8): e73027. Bibcode:2013PLoSO ... 873027C. Дои:10.1371 / journal.pone.0073027. ЧВК 3754922. PMID 24014084.
- ^ Mueggenburg KE, Lin XM, Goldsmith RH, Jaeger HM (сентябрь 2007 г.). «Эластичные мембраны плотноупакованных массивов наночастиц». Материалы Природы. 6 (9): 656–60. Bibcode:2007НатМа ... 6..656М. Дои:10.1038 / nmat1965. PMID 17643104. S2CID 444592.
- ^ Хе Дж, Канджанабус П., Фрейзер Н.Л., Вейс А., Линь XM, Джегер Х.М. (июль 2010 г.). «Изготовление и механические свойства крупномасштабных автономных мембран наночастиц». Маленький. 6 (13): 1449–56. Дои:10.1002 / smll.201000114. PMID 20521265. S2CID 206491859.
- ^ Ван И, Канджанабус П., Барри Э., МакБрайд С., Линь XM, Джегер Х.М. (февраль 2014 г.). «Разрушение и разрушение монослоев и мультислоев наночастиц». Нано буквы. 14 (2): 826–30. Bibcode:2014NanoL..14..826Вт. Дои:10.1021 / nl404185b. PMID 24467462. S2CID 207673690.
- ^ Ван И, Ляо Дж., Макбрайд С.П., Эфрати Э., Линь XM, Джегер Х.М. (октябрь 2015 г.). «Сильное сопротивление изгибу, наблюдаемое для мембран из наночастиц». Нано буквы. 15 (10): 6732–7. Bibcode:2015NanoL..15.6732Вт. Дои:10.1021 / acs.nanolett.5b02587. PMID 26313627. S2CID 29849022.
- ^ Гриземер С.Д., Ю СС, Канджанабус П., Калабро М., Джагер Х.М., Райс С.А., Лин Б. (май 2017 г.). «Роль лигандов в механических свойствах пленок ленгмюровских наночастиц». Мягкая материя. 13 (17): 3125–3133. Bibcode:2017SMat ... 13,3125G. Дои:10.1039 / c7sm00319f. PMID 28397901.
- ^ а б c Сперлинг Р.А., Парак В.Дж. (март 2010 г.). «Модификация поверхности, функционализация и биоконъюгирование коллоидных неорганических наночастиц». Философские труды. Серия A, математические, физические и инженерные науки. 368 (1915): 1333–83. Bibcode:2010RSPTA.368.1333S. Дои:10.1098 / rsta.2009.0273. PMID 20156828.
- ^ Тауран И., Бриуд А., Коулман А. В., Рими М., Ким Б. (август 2013 г.). «Молекулярное распознавание наночастицами золота, серебра и меди». Всемирный журнал биологической химии. 4 (3): 35–63. Дои:10.4331 / wjbc.v4.i3.35. ЧВК 3746278. PMID 23977421.
- ^ Тагучи Т., Исодзаки К., Мики К. (декабрь 2012 г.). «Повышенная каталитическая активность самоорганизующихся монослойных наночастиц золота». Современные материалы. 24 (48): 6462–7. Дои:10.1002 / adma.201202979. PMID 22968900. S2CID 205247206.
- ^ Heinecke CL, Ni TW, Malola S, Mäkinen V, Wong OA, Häkkinen H, Ackerson CJ (август 2012 г.). «Структурные и теоретические основы обмена лигандов на нанокластерах золота, защищенных тиолатным монослоем». Журнал Американского химического общества. 134 (32): 13316–22. Дои:10.1021 / ja3032339. ЧВК 4624284. PMID 22816317.
- ^ Перумал С., Хофманн А., Шольц Н., Рюль Е., Граф С. (апрель 2011 г.). «Исследование кинетики связывания поливалентных лигандов на выбранных по размеру наночастицах золота». Langmuir. 27 (8): 4456–64. Дои:10.1021 / la105134m. PMID 21413796.
- ^ МакМахон Дж. М., Эмори С. Р. (январь 2007 г.). «Фазовый переход крупных наночастиц золота в органические растворители с повышенной стабильностью». Langmuir. 23 (3): 1414–8. Дои:10.1021 / la0617560. PMID 17241067.
- ^ Tyo EC, Vajda S (июль 2015 г.). «Катализ кластерами с точным числом атомов». Природа Нанотехнологии. 10 (7): 577–88. Bibcode:2015НатНа..10..577Т. Дои:10.1038 / nnano.2015.140. PMID 26139144.
- ^ Ню З, Ли Й (2014-01-14). «Удаление и использование укупорочных агентов в нанокатализе». Химия материалов. 26 (1): 72–83. Дои:10,1021 / см 4022479.
- ^ Хаккинен Х., Вальтер М., Грёнбек Х. (май 2006 г.). «Разделяй и защищай: закрытие нанокластеров золота молекулярными кольцами тиолата золота». Журнал физической химии B. 110 (20): 9927–31. Дои:10.1021 / jp0619787. PMID 16706449.
- ^ Реймерс Дж. Р., Форд М. Дж., Гальдер А., Улструп Дж., Хаш Н. С. (март 2016 г.). «Золотые поверхности и наночастицы защищены частицами Au (0) -тила и разрушаются при образовании Au (I) -тиолатов». Труды Национальной академии наук Соединенных Штатов Америки. 113 (11): E1424–33. Bibcode:2016PNAS..113E1424R. Дои:10.1073 / pnas.1600472113. ЧВК 4801306. PMID 26929334.
- ^ Park JW, Shumaker-Parry JS (февраль 2014 г.). «Структурное исследование цитратных слоев на наночастицах золота: роль межмолекулярных взаимодействий в стабилизации наночастиц». Журнал Американского химического общества. 136 (5): 1907–21. Дои:10.1021 / ja4097384. PMID 24422457.
- ^ а б c Алкилани AM, Мерфи CJ (сентябрь 2010 г.). «Токсичность и поглощение наночастиц золота клетками: что мы узнали на данный момент?». Журнал исследований наночастиц. 12 (7): 2313–2333. Bibcode:2010JNR .... 12.2313A. Дои:10.1007 / s11051-010-9911-8. ЧВК 2988217. PMID 21170131.
- ^ Перала С.Р., Кумар С. (август 2013 г.).«О механизме синтеза металлических наночастиц в методе Брюста-Шиффрина». Langmuir. 29 (31): 9863–73. Дои:10.1021 / la401604q. PMID 23848382.
- ^ а б c Алкилани AM, Нагария П.К., Hexel CR, Шоу Т.Дж., Мерфи С.Дж., Вятт, доктор медицины (март 2009 г.). «Поглощение клетками и цитотоксичность золотых наностержней: молекулярное происхождение цитотоксичности и поверхностные эффекты». Маленький. 5 (6): 701–8. Дои:10.1002 / smll.200801546. PMID 19226599.
- ^ Такахаши Х., Нийдоме Й., Ниидоме Т., Канеко К., Кавасаки Х., Ямада С. (январь 2006 г.). «Модификация золотых наностержней с использованием фосфатидилхолина для снижения цитотоксичности». Langmuir. 22 (1): 2–5. Дои:10.1021 / la0520029. PMID 16378388.
- ^ а б c Гудман К.М., Маккаскер CD, Йилмаз Т., Ротелло В.М. (июнь 2004 г.). «Токсичность наночастиц золота, функционализированных катионными и анионными боковыми цепями». Биоконъюгат Химия. 15 (4): 897–900. Дои:10.1021 / bc049951i. PMID 15264879.
- ^ Коннор Е.Е., Мвамука Дж., Гоул А., Мерфи С.Дж., Вятт, доктор медицины (март 2005 г.). «Наночастицы золота поглощаются человеческими клетками, но не вызывают острой цитотоксичности». Маленький. 1 (3): 325–7. Дои:10.1002 / smll.200400093. PMID 17193451.
- ^ Добровольская М.А., Патри А.К., Чжэн Дж., Клогстон Дж. Д., Аюб Н., Аггарвал П., Нойн Б. В., Холл Дж. Б., Макнил С. Е. (июнь 2009 г.). «Взаимодействие наночастиц коллоидного золота с кровью человека: влияние на размер частиц и анализ профилей связывания с белками плазмы». Наномедицина. 5 (2): 106–17. Дои:10.1016 / j.nano.2008.08.001. ЧВК 3683956. PMID 19071065.
- ^ Чен Ю.С., Хунг Ю.С., Ляу И., Хуан Г.С. (май 2009 г.). «Оценка токсичности наночастиц золота in vivo». Письма о наномасштабных исследованиях. 4 (8): 858–864. Bibcode:2009НРЛ ..... 4..858С. Дои:10.1007 / s11671-009-9334-6. ЧВК 2894102. PMID 20596373.
- ^ Чо ВС, Чо М, Чон Дж., Чой М, Чо Х.Й., Хан Б.С., Ким Ш., Ким Хо, Лим Й.Т., Чунг Б.Х., Чон Дж. (Апрель 2009 г.) «Острая токсичность и фармакокинетика наночастиц золота размером 13 нм, покрытых ПЭГ». Токсикология и прикладная фармакология. 236 (1): 16–24. Дои:10.1016 / j.taap.2008.12.023. PMID 19162059.
- ^ Греф Р., Куврёр П., Баррат Г., Мисиакин Е. (ноябрь 2003 г.). «Наночастицы поверхностной инженерии для множественного связывания лигандов». Биоматериалы. 24 (24): 4529–37. Дои:10.1016 / s0142-9612 (03) 00348-х. PMID 12922162.
- ^ Boisselier E, Astruc D (июнь 2009 г.). «Золотые наночастицы в наномедицине: препараты, визуализация, диагностика, методы лечения и токсичность». Обзоры химического общества. 38 (6): 1759–82. Дои:10.1039 / b806051g. PMID 19587967.
- ^ Тандон А., Шарма А., Родье Дж. Т., Клибанов А. М., Ригер Ф. Г., Мохан Р. Р. (июнь 2013 г.). «Перенос гена BMP7 через наночастицы золота в строму подавляет фиброз роговицы in vivo». PLOS ONE. 8 (6): e66434. Bibcode:2013PLoSO ... 866434T. Дои:10.1371 / journal.pone.0066434. ЧВК 3682981. PMID 23799103.
- ^ Gratton SE, Pohlhaus PD, Lee J, Guo J, Cho MJ, Desimone JM (август 2007 г.). «Нанофабрикованные частицы для инженерной лекарственной терапии: предварительное исследование биораспределения наночастиц PRINT». Журнал контролируемого выпуска. 121 (1–2): 10–8. Дои:10.1016 / j.jconrel.2007.05.027. ЧВК 1994820. PMID 17643544.
- ^ а б c Де Йонг WH, Хагенс В.И., Krystek P, Burger MC, Sips AJ, Geertsma RE (апрель 2008 г.). «Распределение наночастиц золота в органах в зависимости от размера частиц после внутривенного введения». Биоматериалы. 29 (12): 1912–9. Дои:10.1016 / j.biomaterials.2007.12.037. PMID 18242692.
- ^ Кассано, Доменико; Мапанао, Ана-Катрина; Сумма, Мария; Вламидис, Илеа; Джанноне, Джулия; Санти, Мелисса; Гуццолино, Елена; Питто, Летиция; Полисено, Лаура; Берторелли, Розалия; Волиани, Валерио (21.10.2019). «Биобезопасность и биокинетика благородных металлов: влияние их химической природы». ACS Applied Bio Materials. 2 (10): 4464–4470. Дои:10.1021 / acsabm.9b00630. ISSN 2576-6422.
- ^ Кассано, Доменико; Сумма, Мария; Покови-Мартинес, Сальвадор; Мапанао, Ана-Катрина; Кателани, Тициано; Берторелли, Розалия; Волиани, Валерио (февраль 2019 г.). «Биоразлагаемые ультрамалые структуры в нано-золоте: среднесрочная оценка распределения и выделения in vivo». Определение характеристик частиц и систем частиц. 36 (2): 1800464. Дои:10.1002 / ppsc.201800464.
- ^ Туркевич Дж, Стивенсон П.К., Хиллиер Дж. (1951). «Исследование процессов зародышеобразования и роста при синтезе коллоидного золота». Обсуждать. Фарадей Соц. 11: 55–75. Дои:10.1039 / df9511100055. S2CID 97664009.
- ^ Кимлинг Дж., Майер М., Окенве Б., Котайдис В., Бюллетень Н, Плеч А (август 2006 г.). «Новый взгляд на метод Туркевича для синтеза наночастиц золота». Журнал физической химии B. 110 (32): 15700–7. Дои:10.1021 / jp061667w. PMID 16898714. S2CID 11729630.
- ^ а б Френс, Г. (1972). «Размер частиц и стабильность золя в металлических коллоидах». Коллоидная и полимерная наука. 250 (7): 736–741. Дои:10.1007 / bf01498565. S2CID 92726968.
- ^ а б Френс, Г. (1973). «Контролируемое зародышеобразование для регулирования размера частиц в монодисперсных суспензиях золота». Природа. 241 (105): 20–22. Bibcode:1973НФС..241 ... 20Ф. Дои:10.1038 / Physci241020a0.
- ^ Понг Б.К., Элим Х.И., Чонг Дж.Х., Форель Б.Л., Ли Дж.Й. (2007). «Новые сведения о механизме роста наночастиц в восстановлении цитрата золотой (III) соли: образование промежуточного продукта нанопроволоки Au и его нелинейные оптические свойства». J. Phys. Chem. C. 111 (17): 6281–6287. Дои:10.1021 / jp068666o.
- ^ Niu Z, Li Y (2014). «Удаление и использование укупорочных агентов в нанокатализе». Химия материалов. 26: 72–83. Дои:10,1021 / см 4022479.
- ^ Фанг Й, Тан Дж, Лан Т, Фу С.Г., Пюн Д.Г., Лим С., Ким Д. (2018). «Универсальный однореакторный, одностадийный синтез нанокомпозитов ядро-оболочка с самоорганизующейся оболочкой из дубильной кислоты и их антибактериальной и каталитической активностью». Журнал прикладной науки о полимерах. 135 (6): 45829. Дои:10.1002 / app.45829.
- ^ Фанг Й, Тан Дж, Чой Х, Лим С., Ким Д. (2018). «Высокочувствительное обнаружение невооруженным глазом железа (III) и H2O2 с использованием нанокомпозита Au, покрытого поли (дубильной кислотой) (PTA)». Датчики и исполнительные механизмы B: химические. 259: 155–161. Дои:10.1016 / j.snb.2017.12.031.
- ^ Brust M, Walker M, Bethell D, Schiffrin DJ, Whyman R (1994). «Синтез наночастиц золота, дериватизированных тиолами, в двухфазной системе жидкость-жидкость». Chem. Commun. (7): 801–802. Дои:10.1039 / C39940000801.
- ^ Манна А., Чен П., Акияма Х, Вей Т., Тамада К., Нолл В. (2003). «Оптимизированная фотоизомеризация на наночастицах золота, покрытых несимметричными дисульфидами азобензола». Химия материалов. 15 (1): 20–28. Дои:10,1021 / см 0207696.
- ^ Гао Дж., Хуан Х, Лю Х., Цзань Ф., Рен Дж. (Март 2012 г.). «Коллоидная стабильность наночастиц золота, модифицированных тиоловыми соединениями: биоконъюгация и применение в визуализации раковых клеток». Langmuir. 28 (9): 4464–71. Дои:10.1021 / la204289k. PMID 22276658.
- ^ Бекале, Лоран, Саид Барацзук и Сурат Хотчандани. «Выгодная роль наночастиц золота как фотопротектора тетрафенилпорфирина магния». SpringerReference (n.d.): n. стр. Интернет. 14 ноября 2016 г.
- ^ Templeton AC, Wuelfing WP, Murray RW (январь 2000 г.). «Однослойно защищенные кластерные молекулы». Отчеты о химических исследованиях. 33 (1): 27–36. CiteSeerX 10.1.1.501.2383. Дои:10.1021 / ar9602664. PMID 10639073.
- ^ Луи С. (2017). «Химическая подготовка наночастиц золота на поверхности». В Louis C, Pluchery O (ред.). Золотые наночастицы для физики, химии и биологии (Второе изд.). Хакенсак (Нью-Джерси); Лондон: World Scientific. п. 155. ISBN 978-1-78634-124-2.
- ^ Перро SD, Чан WC (декабрь 2009 г.). «Синтез и модификация поверхности высокомонодисперсных сферических наночастиц золота размером 50-200 нм». Журнал Американского химического общества. 131 (47): 17042–3. Дои:10.1021 / ja907069u. PMID 19891442.
- ^ Мартин М.Н., Башам Джи, Чандо П., Эа СК (май 2010 г.). «Заряженные наночастицы золота в неполярных растворителях: 10-минутный синтез и 2D-самосборка». Langmuir. 26 (10): 7410–7. Дои:10.1021 / la100591h. PMID 20392108. 3-минутное демонстрационное видео по методу синтеза Мартина доступно на YouTube
- ^ Калишваралал К., Дипак В., Рам Кумар Пандиан С., Гурунатан С. (ноябрь 2009 г.). «Биологический синтез золотых нанокубов из Bacillus licheniformis». Биоресурсные технологии. 100 (21): 5356–8. Дои:10.1016 / j.biortech.2009.05.051. PMID 19574037.
- ^ Navarro JR, Lerouge F, Cepraga C, Micouin G, Favier A, Chateau D, Charreyre MT, Lanoë PH, Monnereau C, Chaput F, Marotte S, Leverrier Y, Marvel J, Kamada K, Andraud C, Baldeck PL, Parola S (Ноябрь 2013). «Наноносители со сверхвысокой хромофорной загрузкой для флуоресцентной биовизуализации и фотодинамической терапии». Биоматериалы. 34 (33): 8344–51. Дои:10.1016 / j.biomaterials.2013.07.032. PMID 23915950.
- ^ Байджент CL, Мюллер G (1980). «Коллоидное золото, приготовленное с помощью ультразвука». Experientia. 36 (4): 472–473. Дои:10.1007 / BF01975154. S2CID 32998274.
- ^ Чжан Дж, Ду Дж, Хан Би, Лю Цзинь, Цзян Т., Чжан Зи (февраль 2006 г.). «Сонохимическое образование монокристаллических нанолент золота». Angewandte Chemie. 45 (7): 1116–9. Дои:10.1002 / ange.200503762. PMID 16389606.
- ^ Сакаи Т., Александридис П. (апрель 2005 г.). «Механизм восстановления иона металлического золота, рост наночастиц и контроль размера в водных растворах амфифильных блок-сополимеров в условиях окружающей среды». Журнал физической химии B. 109 (16): 7766–77. Дои:10.1021 / jp046221z. PMID 16851902.
- ^ Ray D, Aswal VK, Kohlbrecher J (март 2011 г.). "Синтез и характеристика наночастиц золота, опосредованных блок-сополимером высокой концентрации". Langmuir. 27 (7): 4048–56. Дои:10.1021 / la2001706. PMID 21366279.
дальнейшее чтение
- Boisselier E, Astruc D (июнь 2009 г.). «Золотые наночастицы в наномедицине: препараты, визуализация, диагностика, методы лечения и токсичность». Обзоры химического общества. 38 (6): 1759–82. Дои:10.1039 / b806051g. PMID 19587967.
внешняя ссылка
- Мориарти, Филипп. «Au - Золотая наночастица». Шестьдесят символов. Брэди Харан для Ноттингемский университет.
- Доступны поэтапные методы цитратного синтеза и гидрохинонового синтеза наночастиц золота. Вот.



