Хориоаллантоисная мембрана - Chorioallantoic membrane
| Хориоаллантоисная мембрана | |
|---|---|
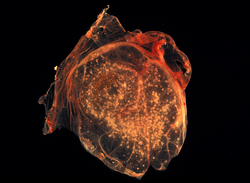 Хориоаллантоисная оболочка развивающегося цыпленка покрыта Вирус оспы шишки | |
| Идентификаторы | |
| MeSH | D049033 |
| Анатомическая терминология | |
В Хориоаллантоисная мембрана (CAM), также известный как хориоаллантоис, представляет собой сильно васкуляризованный мембрана найдено в яйца определенных амниот любить птицы и рептилии. Он образован слиянием мезодермальный слои из двух внеэмбриональные оболочки - в хорион и аллантоис.[1] Это птичка гомолог из млекопитающее плацента. Это самая внешняя внеэмбриональная мембрана, выстилающая несосудистые оболочка яичной скорлупы.
Структура
Хориоаллантоисная мембрана состоит из трех слоев. Первый - хорионический эпителий это внешний слой, находящийся непосредственно под оболочкой оболочки.[2] Он состоит из эпителиальных клеток, которые возникают из хориона. эктодерма. Второй - промежуточный мезодермальный слой, состоящий из мезенхимальный ткань, образованная слиянием мезодермального слоя хориона и мезодермального слоя аллантоиса. Этот слой сильно васкуляризован и богат стромальный компоненты. Третий - это аллантоисный эпителий, который состоит из эпителиальных клеток, возникающих из аллантоисной эктодермы. Он является частью стенки аллантоисного мешка.
Оба эпителиальных слоя отделены от мезодермального слоя подвальные мембраны.[3]
Функция
Хориоаллантоисная мембрана выполняет следующие функции:
CAM функционирует как сайт газообмен для кислород и углекислый газ между растущим эмбрионом и окружающей средой. Кровь капилляры и пазухи находятся в промежуточном мезодермальном слое, допускают тесный контакт (в пределах 0,2 мкм) с воздухом, находящимся в порах оболочки скорлупы яйца.[4]
Хорионический эпителиальный слой содержит область транспорта кальция САМ и, таким образом, отвечает за транспорт ионов кальция из скорлупы яйца в эмбрион с целью окостенение костей развивающихся эмбрион.[2][5] САМ также помогает поддерживать кислотно-щелочной гомеостаз эмбриона.[6] Наконец, аллантоисный эпителий служит барьером для аллантоисной полости и действует в избирательно проницаемый способ, позволяя поглощать воду и электролиты, а также поддерживает барьер против токсины и отходы, хранящиеся внутри аллантоисной полости.[2]
Развитие
Развитие CAM сходно с развитием аллантоиса у млекопитающих. Его рост начинается с 3-го дня эмбрионального развития. Развитие аллантоиса происходит вне эмбриона из вентральный стенка энтодермы задняя кишка. Частичное слияние хориона и аллантоиса происходит между 5 и 6 днями. К 10-му дню происходит обширное образование капиллярной сети. Полный дифференциация CAM завершается к 13 дню.[7][5]
Протоколы выращивания
Хориоаллантоисные мембраны можно культивировать как снаружи (ex-ovo), так и внутри оболочки (in-ovo).
Ex-ovo
Здесь эмбрион выращивается вне скорлупы. В этом методе яйца сначала хранятся в увлажненном помещении. инкубатор на срок до 3 дней, чтобы гарантировать, что положение эмбриона противоположно положению, в котором яйцо впоследствии будет разбито. На боковой стороне воздушной камеры делается небольшое отверстие для уравновешивания давления, после чего яйцо разбивается о чашка Петри.[8]
Этот метод идеально подходит для визуализации растущего эмбриона и манипуляций с ним без ограничений в доступе к эмбриону на разных стадиях развития. Однако процесс требует асептический условия. Также существуют проблемы, связанные с обращением с эмбрионом, поскольку желток мембрана склонна к разрыву как во время, так и после культивирования.[7]
Ин-ово
Здесь эмбрион выращивается в пределах яичной скорлупы. В этом методе оплодотворенные яйца вращаются в инкубаторе в течение трех дней, чтобы предотвратить прилипание эмбриона к оболочкам скорлупы. Затем на яичной скорлупе создается отверстие и оборачивается пленкой для предотвращения обезвоживание и инфекции. Затем яйцо выдерживают в статическом положении до дальнейшего использования. Этот шаг предотвращает прилипание САМ к оболочке оболочки. На 7 день послеоплодотворение, отверстие расширяется для доступа к САМ. [9]
Этот метод предлагает несколько преимуществ перед методом ex-vivo, поскольку физиологическая среда для развивающегося эмбриона остается практически неизменной. Когда они находятся внутри скорлупы, легче поддерживать стерильность, а также целостность САМ и эмбриона.[7] Однако для этого метода требуются хорошие технические навыки. Наличие оболочки вокруг развивающегося эмбриона затрудняет доступ к эмбриону. Есть также ограничения при наблюдении и визуализации развивающегося эмбриона.
Приложения
CAM обеспечивает несколько функций, таких как простота доступа и быстрое развитие мембранной структуры, наличие иммунодефицитной среды,[10] простота визуализации для различных методов визуализации, от микроскопии до сканирования ПЭТ.[7] Таким образом, это делает модель подходящей для ряда исследовательских приложений в области биологических и биомедицинских исследований:
- Развитие сосудов и ангиогенез.
- Ксенотрансплантат исследования.[10]
- Исследование опухоль рост и дифференциация.[11]
- Ремонт раны исследования.
- Токсикология исследования.
- Доставка наркотиков.
- Изучение молекул, влияющих на ангиогенный и антиангиогенная активность.
- Выращивание вирусы как вирус простого герпеса и т. д.[12][13]
- Скрининговые исследования на наркотики.
- Лучевая терапия родственные исследования.
- Исследования аллергенности и токсичности.
- Гельминт выращивание.[14]
Преимущества
Преимущества использования CAM:
- Легко использовать по сравнению с другими животные модели.
- Анализы могут быть визуализированы в реальном времени с использованием очень простых и очень сложных методов визуализации.[7]
- Быстрый рост сосудов.
- Экономичный, легкий доступ.
- В сердечно-сосудистая система полностью доступен, что упрощает доставку внутривенных молекул.
- Анализы занимают относительно меньше времени.
- Легко воспроизводимый и надежный.
Недостатки
Несмотря на многочисленные достоинства, использование CAM имеет ряд недостатков:
- Чувствительность к изменениям условий окружающей среды.[5]
- Ограниченная доступность реагентов, таких как антитела, из-за птичьего происхождения.
- Неспецифическая воспалительная реакция через 15 дней развития.[5]
- Сложность отличить образование новых капилляров от уже существующей сосудистой сети.[7]
- Различия в метаболизме лекарств по сравнению с млекопитающими.
использованная литература
- ^ Гилберт С.Ф. (2003). Биология развития (7-е изд.). Сандерленд, Массачусетс: Sinauer Associates. ISBN 0-87893-258-5. OCLC 51544170.
- ^ а б c Габриэлли MG, Accili D (21 марта 2010 г.). «Хориоаллантоисная мембрана цыпленка: модель молекулярной, структурной и функциональной адаптации к трансэпителиальному переносу ионов и барьерной функции во время эмбрионального развития». Журнал биомедицины и биотехнологии. 2010: 940741. Дои:10.1155/2010/940741. ЧВК 2842975. PMID 20339524.
- ^ Лусимбо В.С., Лейтон Ф.А., Вобезер Г.А. (май 2000 г.). «Гистология и ультраструктура хориоаллантоисной оболочки утки кряквы (Anas platyrhynchos)». Анатомический рекорд. 259 (1): 25–34. Дои:10.1002 / (SICI) 1097-0185 (20000501) 259: 1 <25 :: AID-AR3> 3.0.CO; 2-Y. PMID 10760740.
- ^ Fáncsi T, Fehér G (июнь 1979 г.). «Ультраструктурные исследования хориоаллантоисной мембраны куриного эмбриона в процессе инкубации». Анатомия, гистология, эмбриология. 8 (2): 151–9. Дои:10.1111 / j.1439-0264.1979.tb00687.x. PMID 159001. S2CID 9045456.
- ^ а б c d Рибатти Д. (август 2016 г.). «Хориоаллантоисная мембрана куриного эмбриона (САМ). Многогранная экспериментальная модель». Механизмы развития. 141: 70–77. Дои:10.1016 / j.mod.2016.05.003. PMID 27178379. S2CID 7106191.
- ^ Габриэлли М.Г. (июнь 2004 г.). «Карбоангидразы во внеэмбриональных структурах цыплят: роль CA в реабсорбции бикарбонатов через хориоаллантоисную мембрану». Журнал ингибирования ферментов и медицинской химии. 19 (3): 283–6. Дои:10.1080/14756360410001689568. PMID 15500002. S2CID 11697041.
- ^ а б c d е ж Новак-Сливинская П., Сегура Т., Ируэла-Ариспе М.Л. (октябрь 2014 г.). «Модель куриной хориоаллантоисной мембраны в биологии, медицине и биоинженерии». Ангиогенез. 17 (4): 779–804. Дои:10.1007 / s10456-014-9440-7. ЧВК 4583126. PMID 25138280.
- ^ Шоманн Т., Куннейс Ф., Видера Д., Кальчмидт С., Кальчмидт Б. (2013-03-11). «Улучшенный метод ex ovo-культивирования развивающихся куриных эмбрионов для ксенотрансплантатов стволовых клеток человека». Stem Cells International. 2013: 960958. Дои:10.1155/2013/960958. ЧВК 3608262. PMID 23554818.
- ^ Эль-Гали Н., Рабади М., Эзин А.М., Де Беллар М.Э. (январь 2010 г.). «Новые методы манипуляции с куриным эмбрионом». Микроскопические исследования и техника. 73 (1): 58–66. Дои:10.1002 / jemt.20753. ЧВК 2797828. PMID 19582831.
- ^ а б Эндо Y (2019). «История создания моделей ксенотрансплантатов опухоли куриного эмбриона». Ферменты. 46. Эльзевир. С. 11–22. Дои:10.1016 / bs.enz.2019.08.005. ISBN 978-0-12-817398-5. PMID 31727272.
- ^ ДеБорд Л.С., Патак Р.Р., Вильянеува М., Лю Х.С., Харрингтон Д.А., Ю В. и др. (2018). «Хориоаллантоисная мембрана цыпленка (CAM) как универсальная платформа для ксенотрансплантата (PDX), полученная от пациента, для точной медицины и доклинических исследований». Американский журнал исследований рака. 8 (8): 1642–1660. ЧВК 6129484. PMID 30210932.
- ^ Рибатти Д. (август 2018 г.). «Использование хориоаллантоисной мембраны куриного эмбриона в качестве экспериментальной модели для изучения роста вируса и проверки гипотезы клонального отбора. Вклад сэра Мака Фарлейна Бернета». Письма иммунологии. 200: 1–4. Дои:10.1016 / j.imlet.2018.05.005. PMID 29886119.
- ^ Гай JS (2008). «Выделение и распространение коронавирусов в Эмбрионированный Яйца ». Выделение и распространение коронавирусов в яйцах с эмбрионами. Методы молекулярной биологии. 454. С. 109–17. Дои:10.1007/978-1-59745-181-9_10. ISBN 978-1-58829-867-6. ЧВК 7122360. PMID 19057881.
- ^ Фрид Б., Стейблфорд, LT (1991). «Выращивание гельминтов на куриных эмбрионах». Достижения в паразитологии. 30: 108–65. PMID 2069072.
